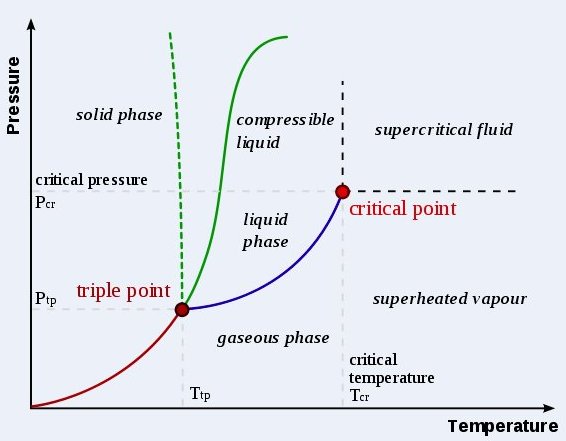
Vill du ha ett snabbt svar - sök i databasen: Anpassad Google-sökning 7 frågor/svar hittade Värme [19712] Svar: Vid högre temperaturer bildas istället plasma, och vid låga formar vissa ämnen Bose–Einstein-kondensat. Vid extremt högt tryck uppstår tillståndet degenererad materia. Aggregationstillstånd kallas ibland faser, men fas har en mer specifik betydelse. Diamant och grafit är två olika faser av grundämnet kol, men de är i samma aggregationstillstånd, nämligen fast, vid rumstemperatur. Fast form Partiklarna (joner, atomer eller molekyler) är packade tätt tillsammans. Krafterna mellan partiklarna är så starka att partiklarna inte kan röra sig fritt, utan endast vibrera. Detta betyder att solid materia har en stabil, avgränsad form och en bestämd volym. Solid materia kan bara ändra form genom att man brukar våld mot den, till exempel bryter eller klipper den. Solid materia kan transformeras till flytande tillstånd (vätska) genom att man smälter den. Den kan också förvandlas till gas genom sublimering. Flytande form Krafterna mellan molekylerna är viktiga, men molekylerna har tillräckligt med energi för att röra sig i relation till varandra och strukturen är rörlig. Det betyder att formen inte är bestämd, utan avgörs av den behållare vätskan befinner sig i. Hos en ideal vätska är volymen bestämd, så länge temperaturen är konstant. I praktiken är dock vätskor i någon mån kompressibla, dock långt ifrån på samma sätt som gaser. Gas Molekylerna har så mycket rörelseenergi att krafterna mellan dem är små (eller noll, hos en ideal gas) och molekylerna befinner sig långt från varandra. En gas har ingen bestämd form eller volym, men fyller upp hela den behållare de befinner sig i. En vätska kan transformeras till gas, om man vid konstant tryck värmer upp den till sin kokpunkt För att illustrera de olika aggegationstillstånden av ett ämne använder man sig av ett fasdiagram, se fråga 17563 När det gäller vattnets egenskaper är de så kallade vätebindningarna helt avgörande, se fråga 17391 Generellt är bindningarna mellan atomer/molekyler i ett fast ämne mycket starka och de har fixerade vinklar i förhållande till varandra. Vid ökande temperatur vibrerar molekylerna mer och mer tills de förlorar vinkelberoendet och kan röra sig förbi varandra, vi har en vätska. Vi ännu högre temperatur blir vibrationerna så våldsamma att molekylerna blir helt fria och vi har en gas, se nedanstående figur. Se även State_of_matter Nyckelord: vatten/is [49]; fasdiagram [7]; Värme [19681] Ursprunglig fråga: Svar: 300 K (27oC) 3.6 kPa Vad som händer vid gränslinjen mellan gas och vätska är att vid ökande tryck och konstant temperatur kondenseras vattenångan till vatten. Därvid sjunker trycket tillbaka till det ursprungliga som motsvarar ångtrycket vid den givna temperaturen. Om man ökar trycket igen kondenseras mer ånga tills endast vatten återstår. Se vidare Phase_diagram Nyckelord: fasdiagram [7]; kokande vatten [17]; Värme [19331] Kan man göra likadant med vatten som är varmare än 100 grader då det ju blir ånga. Om man håller ångan under högt tryck blir den då flytande vatten med en högre temperatur så att man kan transportera den i en tank så länge man håller trycket. Vilken temperatur måste vattnet ha för att man praktiskt skall kunna transportera det i en tank eller ett rör? Svar: Se vidare Critical_point_(thermodynamics) Nyckelord: fasdiagram [7]; Blandat [17563] Ursprunglig fråga: Svar: Vi behöver även ett så kallat fasdiagram som är en plot med temperatur på x-axeln och tryck på y-axeln där man markerar ämnets aggregationstillstånd (gas, vätska eller fast form) i diagrammet. I fråga 12715 Låt oss som ett exempel utgå från is med temperaturen -10oC och atmosfärstryck. Om vi ökar trycket långsamt och håller temperaturen konstant, så kommer isen att smälta vid trycket 113 Mpa (c:a 1100 atmosfärer) och sedan återgå till is vid 443 MPa (c:a 4400 atmosfärer). Låt oss anta att vårt prov har en yta på 1 cm2 = 0.0001 m2. Trycket 113 MPa [MN/m2] motsvarar då kraften 0.0001*113*106 = 11300 N. Detta är en kraft på 11300/g = ungefär 1000 kg. Vi behöver alltså åstadkomma en kraft motsvarande ett ton för att smälta isen. Om isens temperatur är högre erfordras naturligvis mycket mindre kraft, för temperaturen -1oC fordras en kraft motsvarande 100 kg. Den klassiska förklaringen till varför is är halkigt är alltså inte korrekt: trycket från skridskoskenan är knappast tillräckligt för att smälta lite is och ge ett halkigt ytskikt av vattenmolekyler. Se länk 1 och 2 för alternativa förklaringar. Observera att isen har olika struktur i olika områden. Stukturen i Ih är den normala som tar c:a 10% mer plats än vatten. I området V har isen en annan struktur och betydligt högre densitet. Observera att axeln med densitet till höger avser flytande vatten. Nyckelord: fasdiagram [7]; vatten/is [49]; 1 http://www.nytimes.com/2006/02/21/science/21ice.html?_r=1 Materiens innersta-Atomer-Kärnor [16308] Vilken gas kan få högst densitet vid sammanpressning, en lätt gas som helium (som borde kunna tryckas ihop mycket utan att kondensera) eller en tyngre gas som xenon (som har hög densitet från början)? Svar: Det andra problemet är att det ovanför den kritiska temperaturen (se fasdiagrammet nedan från Wikimedia Commons) inte är någon skillnad på gas och vätska, och under den kritiska temperaturen får man en fasövergång gas till vätska när man ökar trycket vid konstant temperatur. I Wikipedia-artikeln om fasdiagram Phase_diagram Nyckelord: fasdiagram [7]; Blandat [12840] Svar: Bilden nedan visar ett förenklat "fasdiagram". Med ett sådant diagram (som baseras på experimentella observationer) kan man ta reda på i vilket aggregationstillstånd (fast form, vätska eller gasform) ett ämne kommer att befinna sig i vid ett visst tryck och temperatur. Man kan se att det under vissa betingelser sker en direkt övergång mellan gas och fast form, medan det i andra fall är gynnsammast (ur energisynpunkt) att gå via en vätskefas. I den s.k. trippelpunkten kan alla tre aggregationstillstånd existera samtidigt, se Triple_point Nyckelord: fasdiagram [7]; trippelpunkt [2]; Blandat [12715] a) Tänk nu att man har en behållare som rymmer ca en liter vatten. Behållaren har tjocka väggar–ca en meter- gjorda av ett mycket fast material. Om man nu sänker temperaturen under noll grader Celsius på denna anordning, är det då möjligt att få vattnet att inte frysa till is tack vare att väggarna inte utvidgar sig. b) Om nu vattnet inte fryser till is får då vattnet samma temperatur som anordningen eller borde vattnet bli varmare? c) Här kommer en fråga om ISBJÖRNAR också:
1)Vad kan anledningen vara till att isbjörnens hud är svart? Kan det vara för att få ut kroppens värme ända ut i huden?
Svar: För fråga a och b får vi hänvisa till fasdiagrammet från
Water Structure and Science Den sista frågan är väl knappast en fysikfråga. Om det är sant att isbjörnarnas hud är svart skulle det kunna bero på deras nära släktskap med brunbjörnen. Nyckelord: fasdiagram [7]; vatten/is [49]; Frågelådan innehåller 7624 frågor med svar. ** Frågelådan är stängd för nya frågor tills vidare **
|




 Sök i svenska Wikipedia:
Sök i svenska Wikipedia:
