Vill du ha ett snabbt svar - sök i databasen
Nyckelord: elektronskal
7 träffar
Varför heter det innersta elektronskalet K-skalet och inte t ex A-skalet?
1997-01-20
I sin artikel The Spectra of the Fluorescent Röntgen Radiations i Phil.
Mag 22 396 (1911) inför Charles G. Barkla beteckningarna K och L för de två observerade klart åtskilda serierna i den karakteristiska
röntgenstrålningen. I en not nämner han att dessa tidigare
betecknades med B och A (Proc. Camb. Phil. Soc. May 1909). Bokstäverna K och L är emellertid
lämpligare eftersom det är mycket troligt att serier av strålning
existerar som absorberas lättare eller är mer genomträngande. Det är att märka att Barkla i sin
nobelföreläsning 1918 för 1917 års nobelpris i fysik nämner att han
har troliga bevis för en energirik J-strålning. En sådan strålning har icke verifierats.
Varför Barkla just valde bokstäverna K och L kan vi gissa oss till.
I läroböcker från tidigt 20-tal finner vi att K och L relateras till
kort- och långvågig strålning. Det ligger nära till hands att tro att K och L är förkortningar
för kurz och lang, men 1911 hade man ännu inte mätt strålningens
våglängd. Dessutom var Barkla engelsman. Förmodligen är förklaringen att Barkla valt bokstäver
mitt i alfabetet för att få plats med oupptäckt strålning av både
mjukare och hårdare karaktär.
2000-04-06
Jag har några frågor angående Pauliprincipen, vad innebär den?
Vad betecknar elektronernas olika kvanttal för något? Vad är ett
röntgenspektrum och hur uppkommer det?
/Cecilia K, Katedral, Växjö 1998-04-01
Enligt kvantmekaniken kan en elektron i atomens elektronkal endast befinna sig i vissa tillstånd. Enligt
Pauliprincipen kan två elektroner aldrig befinna sig i samma tillstånd.
Analogi Man placerar elektronerna i atomens elektronskal ungefär
som böcker i en bokhylla. På varje plats får det bara rum en bok.
Varje elektron har fyra olika kvanttal: n, l, m, ms.
Det är svårt att ge en exakt definition av dem på "gymnasiefysiknivå". Istället
får vi ge en enkel bild enligt Bohrs atommodell.
n betecknar antalet nollställen i den radiella vågfunktionen + 1.
l anger hur utdragen banan är.
m anger hur banans plan lutar.
ms anger om spinnet är upp eller ner.
Ett röntgenspektrum uppkommer om man lyckas ta bort en elektron från ett inre skal
i atomen. När någon av de yttre elektronerna "hoppar in" till den tomma platsen
så sänds en röntgenfoton ut.
/GO 1998-04-09
Varför har Osmium och Iridium högst densitet av alla grundämnen?
Osmium och Iridium är ju de tyngsta grundämnena vi känner till. Finns det någon fysikalisk förklaring till varför det förehåller sig så? Finns det materia på vår jord med ännu högre densitet eller går det att skapa på konstgjord väg. Går det s a s att "packa" i hop atomerna på samma sätt som man kramar en snöboll.
/Fredrick A, 2003-10-03
Intressant fråga, men ganska svår att reda ut ordentligt.
Densiteten hos ett ämne beror dels på kärnans massa och dels på
elektronskalens uppbyggnad. Så här ser densiteten av grundämnena ut:
WebElements - density of elements
Ämnena med störst densitet är
Ämne Z Densitet (g/cm3)
Os 76 22.61
Ir 77 22.65
Pt 78 21.09
Ökande laddning (Z) gör att atomskalen krymper och densiteten ökar. Massan ökar också med Z. Det kan då tyckas konstigt att platina har lägre densitet är iridium. Det måste bero på att "packningseffektiviteten" i kristallen är sämre för Pt än Ir.
Om vi tittar på elektronstrukturen finner vi Ir [Xe].4f14.5d7.6s2 och Pt [Xe].4f14.5d9.6s1. Troligtvis gör det större antalet 5d (9 mot 7) elektroner att den effektiva radien blir större för Pt än för Ir.
Densiteten ökar med trycket, men mycket lite. Som vi sett är det elektronerna som bestämmer densiteten. Enda sättet att öka densiteten väsentligt är att göra av med elektronerna. Detta sker i neutronstjärnor där den enorma gravitationen får elektronerna att slå sig ihop med protoner för att bilda neutroner.
/Peter E 2003-10-04
Valenselektroner och elektronskal
Jag undrar hur man kan på bästa sätt förklara vad ett valenselektroner är och vad är ett elektronskal.
/Malin J, Ljungbacken, lidingö 2009-11-17
Malin! Är du inte lite ung för att fundera på elektronskal och valenselektroner? :-)
Atomkärnor har 1 till c:a 100 positivt laddade protoner (och ett antal neutroner som vi inte behöver bekymra oss för). För att atomen skall vara oladdad måste den ha samma antal negativa elektroner som den har protoner. Detta antal kallas för atomnummer, och bestämmer vilket grundämne vi har att göra med.
Enligt
Sammanfattning:
En
/Peter E 2009-11-17
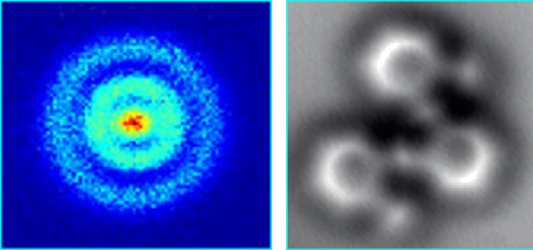
Hur väl kan man avbilda en atom?
På samma sätt som en färgad pixel på datorn byter plats och det då ser ut som det rör sig på datorn, hur lite kan en atom röra sig? Alltså, vad är minsta avståndet som en atom rör sig för att faktiskt ha rört sig?
/Sixten F, Alléskolan, Floda 2014-05-02
Hej Sixten! Jag är inte helt säker på vad du menar. Jag antar du vill veta hur väl kan man avbilda en atom. Det finns numera flera olika metoder att avbilda atomer.
Bilden nedan till vänster visar en bild på en väteatom framställd med en teknik som kallas kvantmikroskopi (eller fotojonisationsmikroskopi), se länk 1. Man kan se hur elektronen rör sig i ett antal moln på olika avstånd från protonen och inte i en planetbana som i Bohrs enkla atommodell.
I bilden nedan till höger (länk 2) har man använt atomkraftsmikroskopi (se Atomkraftsmikroskopi
 ) för att avbilda en molekyl bestående av kolatomer och väteatomer. Man kan tydligt se att kolatomerna förekommer i sexkantiga bensenringar.
) för att avbilda en molekyl bestående av kolatomer och väteatomer. Man kan tydligt se att kolatomerna förekommer i sexkantiga bensenringar. En atom har en radie på ungefär 1/10 nanometer, så upplösningen är alltså betydligt bättre än detta.
Nobelpriset i kemi för 2014 var för högupplöst avbildning med fotoner:
Hur beror energitillstånden hos en flerelektron atom på kvanttalet l?
Hur beror energitillstånden hos en flerelektron atom på kvanttalet l, och hur kan man förstå den
variationen?
/mayu m, 2014-07-18
För givet huvudkvantal n har man ban-kvanttal l = n-1,,,0. Det lägre värdet på l har lägst energi. Det beror på att för låga l-värden penetrerar vågfunktionen mer innanför de negativa laddningarna från lägre liggande elektroner, se nedanstående bild från Hyperphysics. Elektronen kommer då att utsättas för en högre effektiv positiv laddning från kärnan, vilket gör att den blir mer bunden.
Kvanttalet l är ju ett mått på elektronens rörelsemängdsmoment, dvs rXp. Klassiskt sett måste då för l>0 p gå mot oändligheten när r går mot noll. Se fråga [17699] för ett lite mer sofistikerat resonemang.
Se länk 1 fråga [19483] och

Hur bestämmer man värden på kvanttalen; n, l, ml, ms?
Hur bestämmer man värden på kvanttalen; n, l, m, ms? Låt oss säga att den yttersta elektronen hos ett ämne(kalium, natrium, barium, järn m.m.) befinner sig i 4f tillstånd? eller i nåt annat tillstånd.
Vore bra om ni kunde också förklara när de befinner sig på annat tillstånd än 4f .
Och sist men inte minst:
Vilka urvalsregler gäller generellt för optiska övergångar och varför?
Tack på förhand!
/mayu m, 2014-07-18
Kvantmekaniska modeller för elektroner i en atom är mycket exakta, så man kan bestämma kvanttalen för olika tillstånd helt enkelt genom att jämföra experiment med teoretiska beräkningar. Experiment kan vara att observera elektromagnetiska övergångar mellan olika tillstånd eller att se hur atomer bildar kemiska bindningar.
För kärnfysik är din fråga mer relevant eftersom kärntillstånd är mer komplexa och det teoretiska modellerna mindre exakta. För kärntillstånd måste man alltså bestämma kvanttalen genom mätningar av sönderfall och reaktioner, se fråga [15482] och [19317].
De enda tillåtna atomära övergångarna är elektrisk dipol, dvs ändring av J (L+spinn) med högst en enhet och ändring av paritet. Det finns dessutom massor av andra urvalsregler som behandlas i läroböcker.
Se vidare
/Peter E 2014-07-21
Länkar till externa sidor kan inte garanteras bibehålla informationen som fanns vid tillfället när frågan besvarades.
Denna sida från NRCF är licensierad under Creative Commons: Erkännande-Ickekommersiell-Inga bearbetningar