Vill du ha ett snabbt svar - sök i databasen
Nyckelord: atomradie
4 träffar
Varför har Osmium och Iridium högst densitet av alla grundämnen?
Fråga:
Osmium och Iridium är ju de tyngsta grundämnena vi känner till. Finns det någon fysikalisk förklaring till varför det förehåller sig så? Finns det materia på vår jord med ännu högre densitet eller går det att skapa på konstgjord väg. Går det s a s att "packa" i hop atomerna på samma sätt som man kramar en snöboll.
/Fredrick A, 2003-10-03
Osmium och Iridium är ju de tyngsta grundämnena vi känner till. Finns det någon fysikalisk förklaring till varför det förehåller sig så? Finns det materia på vår jord med ännu högre densitet eller går det att skapa på konstgjord väg. Går det s a s att "packa" i hop atomerna på samma sätt som man kramar en snöboll.
/Fredrick A, 2003-10-03
Svar:
Intressant fråga, men ganska svår att reda ut ordentligt.
Densiteten hos ett ämne beror dels på kärnans massa och dels på
elektronskalens uppbyggnad. Så här ser densiteten av grundämnena ut:
WebElements - density of elements . Du kan läsa av ämnet längst ner på sidan om du för musen över ämnet i det periodiska systemet.
. Du kan läsa av ämnet längst ner på sidan om du för musen över ämnet i det periodiska systemet.
Ämnena med störst densitet är
Ökande laddning (Z) gör att atomskalen krymper och densiteten ökar. Massan ökar också med Z. Det kan då tyckas konstigt att platina har lägre densitet är iridium. Det måste bero på att "packningseffektiviteten" i kristallen är sämre för Pt än Ir.
Om vi tittar på elektronstrukturen finner vi Ir [Xe].4f14.5d7.6s2 och Pt [Xe].4f14.5d9.6s1. Troligtvis gör det större antalet 5d (9 mot 7) elektroner att den effektiva radien blir större för Pt än för Ir.
Densiteten ökar med trycket, men mycket lite. Som vi sett är det elektronerna som bestämmer densiteten. Enda sättet att öka densiteten väsentligt är att göra av med elektronerna. Detta sker i neutronstjärnor där den enorma gravitationen får elektronerna att slå sig ihop med protoner för att bilda neutroner.
/Peter E 2003-10-04
Intressant fråga, men ganska svår att reda ut ordentligt.
Densiteten hos ett ämne beror dels på kärnans massa och dels på
elektronskalens uppbyggnad. Så här ser densiteten av grundämnena ut:
WebElements - density of elements
Ämnena med störst densitet är
Ämne Z Densitet (g/cm3)
Os 76 22.61
Ir 77 22.65
Pt 78 21.09
Ökande laddning (Z) gör att atomskalen krymper och densiteten ökar. Massan ökar också med Z. Det kan då tyckas konstigt att platina har lägre densitet är iridium. Det måste bero på att "packningseffektiviteten" i kristallen är sämre för Pt än Ir.
Om vi tittar på elektronstrukturen finner vi Ir [Xe].4f14.5d7.6s2 och Pt [Xe].4f14.5d9.6s1. Troligtvis gör det större antalet 5d (9 mot 7) elektroner att den effektiva radien blir större för Pt än för Ir.
Densiteten ökar med trycket, men mycket lite. Som vi sett är det elektronerna som bestämmer densiteten. Enda sättet att öka densiteten väsentligt är att göra av med elektronerna. Detta sker i neutronstjärnor där den enorma gravitationen får elektronerna att slå sig ihop med protoner för att bilda neutroner.
/Peter E 2003-10-04
Problem med heliumatomens radie
Fråga:
Enligt Nationalencyklopedin är väteatomens radie 53pm
och heliumatomens radie 128 pm. Det "brukar" ju vara så att radien minskar (pga den elektriska kraften mellan kärna och elektroner)om man går från vänster till höger i det periodiska systemet. Finns någon bra förklaring till att heliumatomens radie är så stor?
/Göran K, Malmö Borgarskola, Malmö 2006-05-03
Enligt Nationalencyklopedin är väteatomens radie 53pm
och heliumatomens radie 128 pm. Det "brukar" ju vara så att radien minskar (pga den elektriska kraften mellan kärna och elektroner)om man går från vänster till höger i det periodiska systemet. Finns någon bra förklaring till att heliumatomens radie är så stor?
/Göran K, Malmö Borgarskola, Malmö 2006-05-03
Svar:
Göran! Jag kan inte hitta de siffror du ger. Nationalencyklopedin ger kovalenta radier för H och He som 37pm och 50pm. Det är dock fortfarande så att He är större. Nu är emellertid begeppet kovalent radie för He mycket skumt eftersom definitionen är "den verkningsradie som en atom har då den är kovalent bunden till en annan atom av samma slag". He binder inte till sig själv, så siffran är skum i sig.
ger kovalenta radier för H och He som 37pm och 50pm. Det är dock fortfarande så att He är större. Nu är emellertid begeppet kovalent radie för He mycket skumt eftersom definitionen är "den verkningsradie som en atom har då den är kovalent bunden till en annan atom av samma slag". He binder inte till sig själv, så siffran är skum i sig.
Om vi i stället tittar på teoretiskt beräknade radier från WebElements så ges radierna 37 och 31pm, dvs He är lite mindre. Figuren nedan visar data för alla grundämnen. Man ser att trenden är helt genomgående att det första grundämnet i en period (när ett nytt skal påbörjas) alltid är det med störst radie. Sedan minskar radien eftersom kärnladdningen ökar.
så ges radierna 37 och 31pm, dvs He är lite mindre. Figuren nedan visar data för alla grundämnen. Man ser att trenden är helt genomgående att det första grundämnet i en period (när ett nytt skal påbörjas) alltid är det med störst radie. Sedan minskar radien eftersom kärnladdningen ökar.
Observera emellertid att "atomradie" är ett dåligt definierat begrepp eftersom elektronerna inte går i bestämda banor på ett visst avstånd från kärnan (som planerna gör kring solen), utan de bildar ett "sannolikhetsmoln". T.ex. kan en s-elektron från ett yttre skal i en tung atom faktiskt befinna sig inne i atomkärnan!
Göran! Jag kan inte hitta de siffror du ger. Nationalencyklopedin
Om vi i stället tittar på teoretiskt beräknade radier från WebElements
Observera emellertid att "atomradie" är ett dåligt definierat begrepp eftersom elektronerna inte går i bestämda banor på ett visst avstånd från kärnan (som planerna gör kring solen), utan de bildar ett "sannolikhetsmoln". T.ex. kan en s-elektron från ett yttre skal i en tung atom faktiskt befinna sig inne i atomkärnan!

Hur liten är en atom?
Fråga:
Hur liten är en atom?
/alexandra l, paulinskaskolan, strängnäs 2013-09-12
Hur liten är en atom?
/alexandra l, paulinskaskolan, strängnäs 2013-09-12
Svar:
Hej Alexandra!
Väldigt liten! Järn, t.ex.. har en radie av 126 pm (picometer), se länk 1. Det är 0.000000000126 m. Om man placerar järnatomer i en rad på din nagel (1 cm) så får det plats 0.01/(20.000000000126) = 40.000.000 = 40 miljoner atomer.
Trots att atomer är så små så går det faktiskt att avbilda dem. Bilden längst ner visar rader av guldatomer (se fråga [17235]).
Här är en trevlig video om atomers storlek. Tyvärr på engelska, men det finns text på norska.
Hej Alexandra!
Väldigt liten! Järn, t.ex.. har en radie av 126 pm (picometer), se länk 1. Det är 0.000000000126 m. Om man placerar järnatomer i en rad på din nagel (1 cm) så får det plats 0.01/(20.000000000126) = 40.000.000 = 40 miljoner atomer.
Trots att atomer är så små så går det faktiskt att avbilda dem. Bilden längst ner visar rader av guldatomer (se fråga [17235]).
Här är en trevlig video om atomers storlek. Tyvärr på engelska, men det finns text på norska.

Hur väl kan man avbilda en atom?
Fråga:
På samma sätt som en färgad pixel på datorn byter plats och det då ser ut som det rör sig på datorn, hur lite kan en atom röra sig? Alltså, vad är minsta avståndet som en atom rör sig för att faktiskt ha rört sig?
/Sixten F, Alléskolan, Floda 2014-05-02
På samma sätt som en färgad pixel på datorn byter plats och det då ser ut som det rör sig på datorn, hur lite kan en atom röra sig? Alltså, vad är minsta avståndet som en atom rör sig för att faktiskt ha rört sig?
/Sixten F, Alléskolan, Floda 2014-05-02
Svar:
Hej Sixten! Jag är inte helt säker på vad du menar. Jag antar du vill veta hur väl kan man avbilda en atom. Det finns numera flera olika metoder att avbilda atomer.
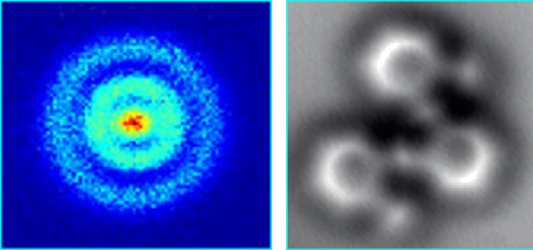
Bilden nedan till vänster visar en bild på en väteatom framställd med en teknik som kallas kvantmikroskopi (eller fotojonisationsmikroskopi), se länk 1. Man kan se hur elektronen rör sig i ett antal moln på olika avstånd från protonen och inte i en planetbana som i Bohrs enkla atommodell.
I bilden nedan till höger (länk 2) har man använt atomkraftsmikroskopi (se Atomkraftsmikroskopi ) för att avbilda en molekyl bestående av kolatomer och väteatomer. Man kan tydligt se att kolatomerna förekommer i sexkantiga bensenringar.
) för att avbilda en molekyl bestående av kolatomer och väteatomer. Man kan tydligt se att kolatomerna förekommer i sexkantiga bensenringar.
En atom har en radie på ungefär 1/10 nanometer, så upplösningen är alltså betydligt bättre än detta.
Nobelpriset i kemi för 2014 var för högupplöst avbildning med fotoner:Super-resolution_microscopy .
Hej Sixten! Jag är inte helt säker på vad du menar. Jag antar du vill veta hur väl kan man avbilda en atom. Det finns numera flera olika metoder att avbilda atomer.
Bilden nedan till vänster visar en bild på en väteatom framställd med en teknik som kallas kvantmikroskopi (eller fotojonisationsmikroskopi), se länk 1. Man kan se hur elektronen rör sig i ett antal moln på olika avstånd från protonen och inte i en planetbana som i Bohrs enkla atommodell.
I bilden nedan till höger (länk 2) har man använt atomkraftsmikroskopi (se Atomkraftsmikroskopi
 ) för att avbilda en molekyl bestående av kolatomer och väteatomer. Man kan tydligt se att kolatomerna förekommer i sexkantiga bensenringar.
) för att avbilda en molekyl bestående av kolatomer och väteatomer. Man kan tydligt se att kolatomerna förekommer i sexkantiga bensenringar. En atom har en radie på ungefär 1/10 nanometer, så upplösningen är alltså betydligt bättre än detta.
Nobelpriset i kemi för 2014 var för högupplöst avbildning med fotoner:
Länkar till externa sidor kan inte garanteras bibehålla informationen som fanns vid tillfället när frågan besvarades.
Denna sida från NRCF är licensierad under Creative Commons: Erkännande-Ickekommersiell-Inga bearbetningar