Vill du ha ett snabbt svar - sök i databasen: Anpassad Google-sökning 12 frågor/svar hittade Materiens innersta-Atomer-Kärnor [21095] Svar: Elektronernas påverkan på kärnradien (och därmed densiteten) är mycket liten, speciellt som kärnradien är dåligt bestämd (14997 Du skall inte föreställa dig elektroner i bestämda banor. Föreställ dig i stället elektronerna som moln vars densitet i olika punkter är proportionell mot sannolikheten att en elektron befinner sig i punkten. Många elektroner har faktiskt en viss sannolikhet att befinna sig inne i kärnan. Nyckelord: elektronskal [12]; Materiens innersta-Atomer-Kärnor [20430] Vad är en spektroskopisk notation ("term-symbolen")?
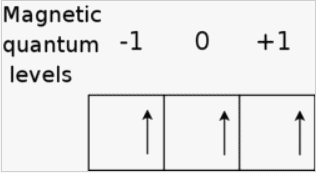
Hur kan man tillämpa detta för grundtillståndet hos en Ar^{2+} jon? Svar: Ar2+ (Z=18) har samma struktur som neutralt S (Z=16) med elektronkonfiguration (se WebElements [Ne].3s2.3p4 och termsymbolen 3P2. Nyckelord: elektronskal [12]; 1 http://www.astro.sunysb.edu/fwalter/AST341/qn.html Materiens innersta-Atomer-Kärnor [19483] Svar: Vi börjar med att ta reda på elektronkonfigurationen för arsenik, se Webelements för arsenik (länk 1). As har alltså 33 elektroner i följande konfiguration: [Ar].3d10.4s2.4p3 De aktiva elektronerna är de tre i 4p-skalet, dvs 3 stycken l=1 (banimpulsmoment) elektroner. Dessa kopplas sedan separat till ett S (totala spinnet) och ett L (totala banimpulsmomentet). Slutligen kopplas det totala banimpulsmomentet L och det totala spinnet S till ett slutligt J (totala rörelsemängdsmomentet). Hunds tre regler beskrivs mycket bra i Hund's_rules 1 Termen med högst multiplicitet ligger lägst. 2 För en given multiplicitet är termen med det största L-värdet det lägsta. 3 För atomer med halvfyllda skal eller mindre är nivån med det lägsta värdet på J den lägsta. Man måste även se till att pauliprincipen uppfylls. 1 Tre elektroner har maximalt S=3/2 och alltså multipliciteten 4. 2 Med alla tre elektroner i samma spinntillstånd (ms=+1/2) måste de ha olika ml dvs -1, 0 och 1 (se nedanstående figur). Detta mosvarar L=0, dvs ett S-tillstånd (att totala spinnet och L=0 båda betecknas med S är lite konfunderande). 3 Med S=3/2 och L=0 är J=3/2 det enda möjliga. Den lägsta nivån (grundtillståndet) är alltså 4S3/2, vilket stämmer bra med Term symbol på sidan länk 1. Nyckelord: elektronskal [12]; pauliprincipen [10]; 1 http://www.webelements.com/arsenic/ Materiens innersta-Atomer-Kärnor [19441] Ursprunglig fråga: Och sist men inte minst:
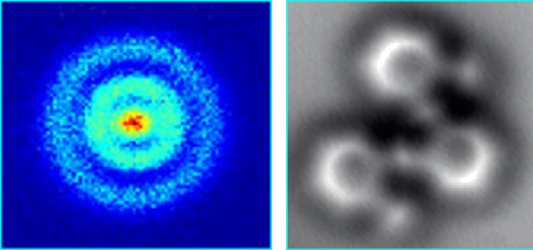
Vilka urvalsregler gäller generellt för optiska övergångar och varför? Tack på förhand! Svar: För kärnfysik är din fråga mer relevant eftersom kärntillstånd är mer komplexa och det teoretiska modellerna mindre exakta. För kärntillstånd måste man alltså bestämma kvanttalen genom mätningar av sönderfall och reaktioner, se fråga 15482 De enda tillåtna atomära övergångarna är elektrisk dipol, dvs ändring av J (L+spinn) med högst en enhet och ändring av paritet. Det finns dessutom massor av andra urvalsregler som behandlas i läroböcker. Se vidare Quantum_number Nyckelord: elektronskal [12]; kvantmekanik [30]; 1 http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch6/quantum.html Materiens innersta-Atomer-Kärnor [19440] Ursprunglig fråga: Svar: Kvanttalet l är ju ett mått på elektronens rörelsemängdsmoment, dvs rXp. Klassiskt sett måste då för l>0 p gå mot oändligheten när r går mot noll. Se fråga 17699 Se länk 1 fråga 19483 Nyckelord: elektronskal [12]; rörelsemängdsmoment [14]; 1 http://hyperphysics.phy-astr.gsu.edu/hbase/quantum/orbdep.html#c2 Materiens innersta-Atomer-Kärnor [19392] Ursprunglig fråga: Svar: Bilden nedan till vänster visar en bild på en väteatom framställd med en teknik som kallas kvantmikroskopi (eller fotojonisationsmikroskopi), se länk 1. Man kan se hur elektronen rör sig i ett antal moln på olika avstånd från protonen och inte i en planetbana som i Bohrs enkla atommodell. I bilden nedan till höger (länk 2) har man använt atomkraftsmikroskopi (se Atomkraftsmikroskopi En atom har en radie på ungefär 1/10 nanometer, så upplösningen är alltså betydligt bättre än detta. Nobelpriset i kemi för 2014 var för högupplöst avbildning med fotoner: Super-resolution_microscopy Nyckelord: atomradie [8]; elektronskal [12]; Bohrs atommodell [9]; 1 http://io9.com/the-first-image-ever-of-a-hydrogen-atoms-orbital-struc-509684901 [17673] Svar: För att bestämma konfigurationen hos valenelektronerna måste man göra en omfattande och realistisk lösning av schrödingerekvationen. Här är konfigurationen för valenselektronerna från WebElements Zr Z=40: [Kr] 4d2 5s2 Med den högre laddningen hos Nb är det tyligen så att det är energetiskt fördelaktigt för en av de två 5s elektronerna att flytta till 4d. Tyvärr tror jag inte man kan förklara fenomenet med ett enkelt resonemang. Nyckelord: elektronskal [12]; Materiens innersta-Atomer-Kärnor [16629] Ursprunglig fråga: Svar: Atomkärnor har 1 till c:a 100 positivt laddade protoner (och ett antal neutroner som vi inte behöver bekymra oss för). För att atomen skall vara oladdad måste den ha samma antal negativa elektroner som den har protoner. Detta antal kallas för atomnummer, och bestämmer vilket grundämne vi har att göra med. Enligt kvantmekanik Sammanfattning: Elektronskal är från varandra avgränsade energiintervall inom vilka elektronerna i en atom kan befinna sig. En valenselektron är en elektron i atomens yttersta skal (valensskalet). Antalet valenselektroner har stor betydelse för vilka kemiska föreningar atomen kan ingå i, det vill säga antalet bestämmer atomslagets kemiska egenskaper. Alla ädelgaser har strukturen ns2np6 i sitt yttre skal. Undantaget He som ju bara ha två elektroner 1s2. Gemensamt för alla ädelgaserna är alltså att det yttersta skalet är fullt (2 elektroner i s-tillstånd och 6 elektroner i p-tillstånd). Nyckelord: elektronskal [12]; Bohrs atommodell [9]; Materiens innersta-Atomer-Kärnor [12738] Tacksamma hälsningar
Svar: Om vi tittar på elektronkonfigurationerna hos lätta och medeltunga grundämnen kan vi sammanställa tabellen nedan, där huvudkvanttalet n alltså börjar räknas från 1.
I fall att "tredje elektronskalet" betyder "alla orbitaler med huvudkvanttalet n=3, där jag börjar räkna n från 1", alltså 3s, 3p och 3d, så kan vi maximalt fylla det med 2+6+10=18 elektroner. Detta är nog den vanligaste definitionen. Tabellen visar också att elektronorbitalerna fylls på i ordningen 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s,... - 4s kommer alltså före 3d. Det beror på att kvantmekaniska effekter ger orbitalen 4s något lägre energi än 3d, så det blir gynnsammare ur energisynpunkt för atomerna att först helt fylla 4s-orbitalen innan 3d tas i bruk. Precis samma resonemang leder till att 5s kommer efter 4p och före 4d, osv. I WebElements Nyckelord: elektronskal [12]; Materiens innersta-Atomer-Kärnor [12220] Ursprunglig fråga: Svar: Densiteten hos ett ämne beror dels på kärnans massa och dels på
elektronskalens uppbyggnad. Så här ser densiteten av grundämnena ut:
WebElements - density of elements Ämnena med störst densitet är Ökande laddning (Z) gör att atomskalen krymper och densiteten ökar. Massan ökar också med Z. Det kan då tyckas konstigt att platina har lägre densitet är iridium. Det måste bero på att "packningseffektiviteten" i kristallen är sämre för Pt än Ir. Om vi tittar på elektronstrukturen finner vi Ir [Xe].4f14.5d7.6s2 och Pt [Xe].4f14.5d9.6s1. Troligtvis gör det större antalet 5d (9 mot 7) elektroner att den effektiva radien blir större för Pt än för Ir. Densiteten ökar med trycket, men mycket lite. Som vi sett är det elektronerna som bestämmer densiteten. Enda sättet att öka densiteten väsentligt är att göra av med elektronerna. Detta sker i neutronstjärnor där den enorma gravitationen får elektronerna att slå sig ihop med protoner för att bilda neutroner. Nyckelord: elektronskal [12]; atomradie [8]; Materiens innersta-Atomer-Kärnor [128] Svar:
Varför Barkla just valde bokstäverna K och L kan vi gissa oss till.
I läroböcker från tidigt 20-tal finner vi att K och L relateras till
kort- och långvågig strålning.
Det ligger nära till hands att tro att K och L är förkortningar
för kurz och lang, men 1911 hade man ännu inte mätt strålningens
våglängd. Dessutom var Barkla
engelsman. Förmodligen är förklaringen att Barkla valt bokstäver
mitt i alfabetet för att få plats med oupptäckt strålning av både
mjukare och hårdare
karaktär. Nyckelord: elektronskal [12]; Materiens innersta-Atomer-Kärnor [1315] Svar:
Analogi Man placerar elektronerna i atomens elektronskal ungefär
som böcker i en bokhylla. På varje plats får det bara rum en bok.
Varje elektron har fyra olika kvanttal: n, l, m, ms.
Det är svårt att ge en exakt definition av dem på "gymnasiefysiknivå". Istället
får vi ge en enkel bild enligt Bohrs atommodell.
n betecknar antalet nollställen i den radiella vågfunktionen + 1.
l anger hur utdragen banan är.
m anger hur banans plan lutar.
ms anger om spinnet är upp eller ner.
Ett röntgenspektrum uppkommer om man lyckas ta bort en elektron från ett inre skal
i atomen. När någon av de yttre elektronerna "hoppar in" till den tomma platsen
så sänds en röntgenfoton ut. Nyckelord: Bohrs atommodell [9]; pauliprincipen [10]; elektronskal [12]; Frågelådan innehåller 7624 frågor med svar. ** Frågelådan är stängd för nya frågor tills vidare **
|


 Sök i svenska Wikipedia:
Sök i svenska Wikipedia:
