Vill du ha ett snabbt svar - sök i databasen
303 frågor / svar hittades
Radioaktivitet
Fråga:
Hej! Jag har några frågor som jag gärna skulle vilja finna svaret på.
1. Emitteras det Beta-minus eller Beta-plus- partiklar från fissionsfragmenten vid en fission? Varför?
2. Naturlig radioaktivitet kan innebära utsändning av alfa-partiklar men aldrig vätekärnor, varför?
3. Vad innebär sekulär jämvikt och hur kommer det sig att aktiviteten är densamma för alla sönderfall i en sönderfallskedja?
/Cornelia K, Katrinelundsgymnasiet, Göteborg 2015-11-14
Hej! Jag har några frågor som jag gärna skulle vilja finna svaret på.
1. Emitteras det Beta-minus eller Beta-plus- partiklar från fissionsfragmenten vid en fission? Varför?
2. Naturlig radioaktivitet kan innebära utsändning av alfa-partiklar men aldrig vätekärnor, varför?
3. Vad innebär sekulär jämvikt och hur kommer det sig att aktiviteten är densamma för alla sönderfall i en sönderfallskedja?
/Cornelia K, Katrinelundsgymnasiet, Göteborg 2015-11-14
Svar:
1 Eftersom fissionsfragmenten har ett överskott an neutroner, se fråga [13690], så sönderfaller ett fissionsfragment genom att minska neutronöverskottet med beta-minussönderfall.
2 Se fråga [15065].
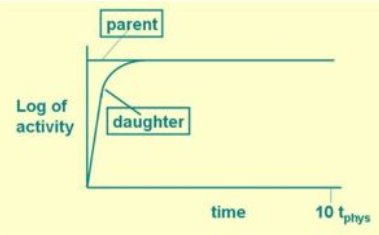
3Sekulär jämvikt i radioaktivt sönderfall är en situation där mängden av en radioaktiv isotop förblir konstant eftersom produktionstakten (t.ex. på grund av sönderfallet av en långlivad moderisotop) är lika med dess avklingningshastighet.
Sekulär jämvikt kan bara ske i en sönderfallskedja om halveringstiden för dotternukliden B är mycket kortare än halveringstiden för modernukliden A. Mängden radionuklid B byggs upp tills antalet B-atomer som sönderfaller per tidsenhet blir lika med antalet som produceras per tidsenhet. Mängden radionuklid B når sedan en konstant jämviktsvärde, se nedanstående figur.
Se även fråga [12858] och [12335].
1 Eftersom fissionsfragmenten har ett överskott an neutroner, se fråga [13690], så sönderfaller ett fissionsfragment genom att minska neutronöverskottet med beta-minussönderfall.
2 Se fråga [15065].
3
Sekulär jämvikt kan bara ske i en sönderfallskedja om halveringstiden för dotternukliden B är mycket kortare än halveringstiden för modernukliden A. Mängden radionuklid B byggs upp tills antalet B-atomer som sönderfaller per tidsenhet blir lika med antalet som produceras per tidsenhet. Mängden radionuklid B når sedan en konstant jämviktsvärde, se nedanstående figur.
Se även fråga [12858] och [12335].
Kärnkraftsavfall
Fråga:
Det som blir kvar när bränslet i ett kärnkraftverk förbrukats är bland annat det radioaktiva ämnet plutonium, som har en halveringstid på 24 000 år
Vad är det som är halverat efter 24 000 år?
Varför är det viktigt att veta om kärnavfalls halveringstid?
/Johannes M, Stockholm, Engelbrektskolan 2015-11-16
Det som blir kvar när bränslet i ett kärnkraftverk förbrukats är bland annat det radioaktiva ämnet plutonium, som har en halveringstid på 24 000 år
Vad är det som är halverat efter 24 000 år?
Varför är det viktigt att veta om kärnavfalls halveringstid?
/Johannes M, Stockholm, Engelbrektskolan 2015-11-16
Svar:
239Pu med halveringstiden 24000 år (länk 1) bildas i reaktorn genom neutroninfångning i 238U. Det är aktiviteten (sönderfall/sekund) av 239Pu som halveras. Avfallet innehåller emellertid även andra långlivade nuklider.
Figuren nedan från fråga [17804] visar den totala aktiviteten från kärnavfall (röd kurva) och den uppskattade aktiviteten hos uranet om det varit kvar i marken. Man kan se att efter 100000 år är aktiviteten hos kärnavfallet lika med det obrutna uranet. Detta är alltså en mycket konservativ gräns för hur länge man måste skydda sig från kärnavfallet.
Mer realistiskt kan man läsa av från kurvan att aktiviteten sjunker från 31019 till 31015 dvs en faktor 10000 på 1000 år. Slutsatsen är alltså att en mycket stor del av den totala aktiviteten kommer från mer korttlivade nuklider, mestadels fissionsprodukter.
239Pu med halveringstiden 24000 år (länk 1) bildas i reaktorn genom neutroninfångning i 238U. Det är aktiviteten (sönderfall/sekund) av 239Pu som halveras. Avfallet innehåller emellertid även andra långlivade nuklider.
Figuren nedan från fråga [17804] visar den totala aktiviteten från kärnavfall (röd kurva) och den uppskattade aktiviteten hos uranet om det varit kvar i marken. Man kan se att efter 100000 år är aktiviteten hos kärnavfallet lika med det obrutna uranet. Detta är alltså en mycket konservativ gräns för hur länge man måste skydda sig från kärnavfallet.
Mer realistiskt kan man läsa av från kurvan att aktiviteten sjunker från 31019 till 31015 dvs en faktor 10000 på 1000 år. Slutsatsen är alltså att en mycket stor del av den totala aktiviteten kommer från mer korttlivade nuklider, mestadels fissionsprodukter.

Radioaktivt sönderfall och tärningskast
Fråga:
Jag gjorde ett experiment där jag använde tärningar för att simulera atomkärnor som sönderfaller, jag hade 60st tärningar till att börja med och efter ett kast räknades alla tärningar som visat siffran 6, vilket skulle symbolisera att en atomkärna sönderfallit och dessa togs sedan bort, sen kastades resterande tärningar och 6:orna plockades bort osv.
Min fråga är nu, vad är det för skillnad på atomkärnor och tärningar? Ger det en bra bild av hur atomkärnor beter sig genom att testa med tärningar?
/Sofie L, 2015-12-12
Jag gjorde ett experiment där jag använde tärningar för att simulera atomkärnor som sönderfaller, jag hade 60st tärningar till att börja med och efter ett kast räknades alla tärningar som visat siffran 6, vilket skulle symbolisera att en atomkärna sönderfallit och dessa togs sedan bort, sen kastades resterande tärningar och 6:orna plockades bort osv.
Min fråga är nu, vad är det för skillnad på atomkärnor och tärningar? Ger det en bra bild av hur atomkärnor beter sig genom att testa med tärningar?
/Sofie L, 2015-12-12
Svar:
Sofie! Ja, din analogi är mycket bra. Den visar tydligt "att Gud spelar tärning", se EPR-paradoxen :-).
:-).
Sönderfallskonstanten l för radioaktivt sönderfall (se fråga [13073]) är sannolikheten för att en kärna skall sönderfalla under en tidsenhet.
Det gäller då att totala aktiviteten (sönderfall/sekund) hos N radioaktiva kärnor ges av
aktivitet = -dN/dt = N l (1)
(minustecknet för att dN är negativt, dvs N minskar med ökande t)
Sannolikheten för att tärningen skall ha värdet 6 är 1/6. Vid N tärningskast förväntar man sig då
N (1/6)
sexor (lyckade utfall).
Antalet sexor när du kastar N tärningar ges alltså av samma uttryck som det radioaktiva sönderfallet om vi identifierar sönderfallskonstanten l med sannolikheten för en sexa 1/6.
Genom att integrera ekvation (1) ovan kan vi få fram ett uttryck för antalet kvarvarande kärnor som funktion av tiden
N(t) = N0 e-lt
där N0 är antalet kärnor från början (t=0).
Se även föreläsningen från Linköpings universitet, länk 1 nedan.
Antalet sönderfall per tidsenhet och antalet sexor vid tärningskast är alltså slumpmässigt fördelade kring förväntningsvärdet (medelvärdet av oändligt många försök) som ges ovan. Fördelningen kallas poissonfördelning, se vidare fråga [16653].
Se ävenRadioactive_decayUniversal_law_of_radioactive_decay .
/Peter E 2015-12-12
Sofie! Ja, din analogi är mycket bra. Den visar tydligt "att Gud spelar tärning", se EPR-paradoxen
 :-).
:-).Sönderfallskonstanten l för radioaktivt sönderfall (se fråga [13073]) är sannolikheten för att en kärna skall sönderfalla under en tidsenhet.
Det gäller då att totala aktiviteten (sönderfall/sekund) hos N radioaktiva kärnor ges av
aktivitet = -dN/dt = N l (1)
(minustecknet för att dN är negativt, dvs N minskar med ökande t)
Sannolikheten för att tärningen skall ha värdet 6 är 1/6. Vid N tärningskast förväntar man sig då
N (1/6)
sexor (lyckade utfall).
Antalet sexor när du kastar N tärningar ges alltså av samma uttryck som det radioaktiva sönderfallet om vi identifierar sönderfallskonstanten l med sannolikheten för en sexa 1/6.
Genom att integrera ekvation (1) ovan kan vi få fram ett uttryck för antalet kvarvarande kärnor som funktion av tiden
N(t) = N0 e-lt
där N0 är antalet kärnor från början (t=0).
Se även föreläsningen från Linköpings universitet, länk 1 nedan.
Antalet sönderfall per tidsenhet och antalet sexor vid tärningskast är alltså slumpmässigt fördelade kring förväntningsvärdet (medelvärdet av oändligt många försök) som ges ovan. Fördelningen kallas poissonfördelning, se vidare fråga [16653].
Se även
/Peter E 2015-12-12
Dimkammare
Fråga:
Hej, till mitt gymnasiearbete har jag konstruerat en dimkammare men jag har lite svårigheter med att identifiera all strålning. Skulle ni kunna förklara hur myoner, alfa partiklar, beta partiklar o.s.v. ser ut i en dimkammare?
/Emelie J, 2016-02-11
Hej, till mitt gymnasiearbete har jag konstruerat en dimkammare men jag har lite svårigheter med att identifiera all strålning. Skulle ni kunna förklara hur myoner, alfa partiklar, beta partiklar o.s.v. ser ut i en dimkammare?
/Emelie J, 2016-02-11
Svar:
De vanligaste spåren är av a-partiklar (korta, raka, tjocka) och elektroner (långa, krokiga, tunna).
Nedanstående bild frånCloud_chamber visar flera olika spår av partiklar, se bildtexten.
I länk 1 finns en intressant bild som innehåller dubbla V-formade a-spår. Det är 220Rn (från sönderfallskedjan 232Th, se fråga [13744]) som sönderfaller till 216Po. 216Po är mycket kortlivat (0.14 s), så dotterkärnan sönderfaller innan den hunnit flytta på sig. Om man tittar noga kan man se att det är en liten fördröjning mellan spåren.
De vanligaste spåren är av a-partiklar (korta, raka, tjocka) och elektroner (långa, krokiga, tunna).
Nedanstående bild från
I länk 1 finns en intressant bild som innehåller dubbla V-formade a-spår. Det är 220Rn (från sönderfallskedjan 232Th, se fråga [13744]) som sönderfaller till 216Po. 216Po är mycket kortlivat (0.14 s), så dotterkärnan sönderfaller innan den hunnit flytta på sig. Om man tittar noga kan man se att det är en liten fördröjning mellan spåren.
This rare picture show the four types of charged particles that we can detect in a cloud chamber : alpha, proton, electron and muon (probably). Picture taken at the Pic duMidi at 2877 m in a Phywe PJ45 diffusion cloud chamber. Size of the interaction surface if 45x45 cm.

Vad finns det för skillnader mellan en ädelgas och ett ämne som har fått ädelgasstruktur?
Fråga:
Vad finns det för skillnader mellan en ädelgas och ett ämne som har fått ädelgasstruktur
/marijana a, örnaskolan, Hyltebruk 2016-02-15
Vad finns det för skillnader mellan en ädelgas och ett ämne som har fått ädelgasstruktur
/marijana a, örnaskolan, Hyltebruk 2016-02-15
Svar:
Enädelgas har fulla yttre elektronskal (valensskal). Valenselektroner (se fråga [16629]) är de yttersta elektronerna i en atom och är normalt sett de enda som är delaktiga i kemiska bindningar. Atomer med fulla valensskal är extremt stabila och bildar därför sällan kemiska föreningar, har låg kokpunkt och de har även svårt att ta till sig eller förlora elektroner.
Tendensen att fulla elektronskal är speciellt stabila finns även hos molekyler. Metan, CH4, är ett enkelt exempel. C har 4 elektroner i sitt valensskal och H har 1. Genom att låta C-atomen "låna" en elektron från vardera H-atomen, får C-atomen en ädelgasstruktur (8 valenselektroner, dvs Ne). Samtidigt kan alla fyra H-atomerna känna sig nöjda med sin ädelgasstruktur (2 valenselektroner, dvs He). Metan har alltså hög bindningsenergi, vilket betyder att det är en stabil molekyl med ganska låg kokpunkt.
/Peter E 2016-02-15
En
Tendensen att fulla elektronskal är speciellt stabila finns även hos molekyler. Metan, CH4, är ett enkelt exempel. C har 4 elektroner i sitt valensskal och H har 1. Genom att låta C-atomen "låna" en elektron från vardera H-atomen, får C-atomen en ädelgasstruktur (8 valenselektroner, dvs Ne). Samtidigt kan alla fyra H-atomerna känna sig nöjda med sin ädelgasstruktur (2 valenselektroner, dvs He). Metan har alltså hög bindningsenergi, vilket betyder att det är en stabil molekyl med ganska låg kokpunkt.
/Peter E 2016-02-15
Hur mäts radonhalten i luften i ett hus?
Fråga:
nukliden 222 Rn är radioaktivt strålning som kommer från ett preparat, hur kan man ta reda på det?
/Hampus P, 2016-05-19
nukliden 222 Rn är radioaktivt strålning som kommer från ett preparat, hur kan man ta reda på det?
/Hampus P, 2016-05-19
Svar:
222Rn (radon-222) sönderfaller genom att sända ut en alfa-partikel, se länk 1. Det är också en ädelgas, så om det bildas i ett preparat så smiter det lätt iväg. Radon detekteras med plastdetektorer som etsas och ger spår man kan räkna. Detektionen är indirekt genom att dotternukliderna fastnar och sönderfaller på detektorn.
Annars används oftast tunna kiseldetektorer för att detektera alfapartiklar.
Se vidareradon och Radon .
.
/Peter E 2016-05-19
222Rn (radon-222) sönderfaller genom att sända ut en alfa-partikel, se länk 1. Det är också en ädelgas, så om det bildas i ett preparat så smiter det lätt iväg. Radon detekteras med plastdetektorer som etsas och ger spår man kan räkna. Detektionen är indirekt genom att dotternukliderna fastnar och sönderfaller på detektorn.
Annars används oftast tunna kiseldetektorer för att detektera alfapartiklar.
Se vidare
 .
./Peter E 2016-05-19
Hur många bindningsmöjligheter har kol?
Fråga:
Jag pluggar till ett prov om organisk kemi och denna frågan dök upp. Hur många bindningsmöjligheter har kol? Varför är det så? Hur skulle man även kunna rita det?
Jag vet att kol har ungefär 4 bindningsmöjlgheter men jag vet inte varför.
Tack i förhand!!
/Bella r, 2016-05-26
Jag pluggar till ett prov om organisk kemi och denna frågan dök upp. Hur många bindningsmöjligheter har kol? Varför är det så? Hur skulle man även kunna rita det?
Jag vet att kol har ungefär 4 bindningsmöjlgheter men jag vet inte varför.
Tack i förhand!!
/Bella r, 2016-05-26
Svar:
Kol har fyra bindningar. Eftersom kol har sex elektroner och två är i ett slutet K-skal blir det fyra elektroner kvar i L-skalet. För maximal kemisk bindning vill man fylla ett skal. För detta krävs alltså fyra bindningar.
Dessa kan t.ex. komma från väte, som har en elektron i lägsta K-skalet. Man har då metan CH4. Metan har av symmetriskäl fyra väteatomer i hörnen av en tetraeder med kolatomen i mitten, se figuren nedan.
Syre har två bindningar eftersom det saknar två elektroner i L-skalet. Syre bildar därför dubbelbindningar med kol t.ex. koldioxid CO2.
Se vidareTetravalence .
Annars är det speciella med kol att den bildar stabila bindningar med sig själv, t.ex. långa kedjor av kol utökat med andra molekyler (egentligen radikaler). Kol finns i flera olika former med olika kol-kol bindningar: grafit, grafen, diamant, fullerener och amorft kol.
Se vidare Kol .
.
Kol har fyra bindningar. Eftersom kol har sex elektroner och två är i ett slutet K-skal blir det fyra elektroner kvar i L-skalet. För maximal kemisk bindning vill man fylla ett skal. För detta krävs alltså fyra bindningar.
Dessa kan t.ex. komma från väte, som har en elektron i lägsta K-skalet. Man har då metan CH4. Metan har av symmetriskäl fyra väteatomer i hörnen av en tetraeder med kolatomen i mitten, se figuren nedan.
Syre har två bindningar eftersom det saknar två elektroner i L-skalet. Syre bildar därför dubbelbindningar med kol t.ex. koldioxid CO2.
Se vidare
Annars är det speciella med kol att den bildar stabila bindningar med sig själv, t.ex. långa kedjor av kol utökat med andra molekyler (egentligen radikaler). Kol finns i flera olika former med olika kol-kol bindningar: grafit, grafen, diamant, fullerener och amorft kol.
Se vidare Kol
 .
.
Varför minskar mobiliteten hos en halvledare med ökande dopningsgrad?
Fråga:
Varför minskar mobiliteten hos en halvledare med ökande dopningsgrad?
/Sara S, Huddingegymnasiet, Huddinge 2016-12-12
Varför minskar mobiliteten hos en halvledare med ökande dopningsgrad?
/Sara S, Huddingegymnasiet, Huddinge 2016-12-12
Svar:
För små värden på dopningen är mobiliteten i stort sett konstant, men för större dopning avtar mobiliteten.
I Wikipedia-artikeln om mobilitet finns det ett empiriskt uttryck för mobiliteten som funktion av dopningsgrad, se
Electron_mobilityDoping_concentration_dependence_in_heavily-doped_silicon .
Anledningen till den avtagande mobiliteten är helt enkelt att dopatomerna "är i vägen" för laddningsbärarna. Dessa sprids av dopatomerna så att hastigheten i fältets rikning minskar. Länk 1 uttrycker det så här:
For low doping concentrations, the mobility is almost constant and is primarily limited by phonon scattering. At higher doping concentrations, the mobility decreases due to ionized impurity scattering with the ionized doping atoms. The actual mobility also depends on the type of dopant. Figure 2.7.3 is for phosphorous and boron doped silicon.
Figuren från länk 1 visas nedan.
För små värden på dopningen är mobiliteten i stort sett konstant, men för större dopning avtar mobiliteten.
I Wikipedia-artikeln om mobilitet finns det ett empiriskt uttryck för mobiliteten som funktion av dopningsgrad, se
Anledningen till den avtagande mobiliteten är helt enkelt att dopatomerna "är i vägen" för laddningsbärarna. Dessa sprids av dopatomerna så att hastigheten i fältets rikning minskar. Länk 1 uttrycker det så här:
For low doping concentrations, the mobility is almost constant and is primarily limited by phonon scattering. At higher doping concentrations, the mobility decreases due to ionized impurity scattering with the ionized doping atoms. The actual mobility also depends on the type of dopant. Figure 2.7.3 is for phosphorous and boron doped silicon.
Figuren från länk 1 visas nedan.

Varför är bindningsenergin per nukleon maximal vid masstalet 56?
Fråga:
Hej hur kommer det säg att atomkärnors massa per nukleon minskar ända till man kommer till Fe-56? Borde det inte vara tvärtom? Det går väl åt mer energi att hålla ihop en större atomkärna än en mindre, således borde väl massan öka per nukleon eftersom energi har massa?
/Emil A, Rudbeck, Örebro 2017-05-06
Hej hur kommer det säg att atomkärnors massa per nukleon minskar ända till man kommer till Fe-56? Borde det inte vara tvärtom? Det går väl åt mer energi att hålla ihop en större atomkärna än en mindre, således borde väl massan öka per nukleon eftersom energi har massa?
/Emil A, Rudbeck, Örebro 2017-05-06
Svar:
Det förklaras utmärkt av vätskedroppsmodellen, se fråga [19103]. Det som gör att bindningsenergin per nukleon inte ökar för tyngre kärnor (se nedanstående figur) är att kärnkraften som håller ihop nukleonerna har mycket kort räckvidd. Detta medför att antalet växelverkande par av nukleoner är proportionellt mot masstalet A (antalet nukleoner) och inte mot A(A-1). Bindningsenergin per nukleon blir då i första approximationen konstant och inte proportionell mot A.
Anledningen till att lätta kärnor har mindre bindningsenergi är att dessa har relativt mer "yta", dvs nukleoner på ytan har färre grannar att växelverka med.
Anledningen till att bindningsenergin per nukleon minskar med ökande A är att coulomb-repulsionen ger negativ bindning. Till skillnad från kärnkraften har coulomb-kraften lång räckvidd, så antalet växelverkningar är proportionellt mot Z(Z-1) där Z är antalet protoner.
Det förklaras utmärkt av vätskedroppsmodellen, se fråga [19103]. Det som gör att bindningsenergin per nukleon inte ökar för tyngre kärnor (se nedanstående figur) är att kärnkraften som håller ihop nukleonerna har mycket kort räckvidd. Detta medför att antalet växelverkande par av nukleoner är proportionellt mot masstalet A (antalet nukleoner) och inte mot A(A-1). Bindningsenergin per nukleon blir då i första approximationen konstant och inte proportionell mot A.
Anledningen till att lätta kärnor har mindre bindningsenergi är att dessa har relativt mer "yta", dvs nukleoner på ytan har färre grannar att växelverka med.
Anledningen till att bindningsenergin per nukleon minskar med ökande A är att coulomb-repulsionen ger negativ bindning. Till skillnad från kärnkraften har coulomb-kraften lång räckvidd, så antalet växelverkningar är proportionellt mot Z(Z-1) där Z är antalet protoner.

Varför förenar sig atomer med varandra?
Fråga:
Hej! jag undrar varför förenar sig egentligen atomer med varandra? förstår att de vill uppnå ädelgasstruktur och ha fullt med valenselektroner i valensskalet men är det bara det? alltså när en atom tar en valenselektrom från en annan så förenas de?
/Madeleine H, färentuna 2018-03-03
Hej! jag undrar varför förenar sig egentligen atomer med varandra? förstår att de vill uppnå ädelgasstruktur och ha fullt med valenselektroner i valensskalet men är det bara det? alltså när en atom tar en valenselektrom från en annan så förenas de?
/Madeleine H, färentuna 2018-03-03
Svar:
Enmolekyl definieras som en grupp av två eller fler atomer ordnade i ett precist arrangemang med hjälp av kovalenta bindningar. En molekyl kan variera i storlek från två atomer, till exempel H2 (vätgas), till tusentals atomer i makromolekyler... När man talar om små molekyler antas de normalt vara oladdade. (Molekyl )
)
Enkemisk bindning är en attraktion mellan atomer, som möjliggör bildandet av kemiska substanser. Attraktionen beror på att det energimässigt är fördelaktigare för de flesta atomer och joner att vara bundna till lämpliga bindningspartners än att förekomma som obundna partiklar. (Kemisk_bindning )
)
Ja, ädelgasstruktur är det mest stabila tillståndet, men i många fall kan det inte bildas eftersom det för en oladdad molekyl fattas elektroner för att fylla det högsta icke tomma skalet. Även om detta inte är fullt har ofta det bundna systemet lägre energi än det obundna där atomerna är helt separerade. Molekyler bildas eftersom naturen strävar mot det lägsta möjliga energitillståndet.
Bindningsenergin för en liten molekyl är några eV, seBond-dissociation_energy . Bindningsenergin frigöres när molekylen bildas genom en kemisk reaktion.
Se även fråga [15130].
/Peter E 2018-03-03
En
 )
)En
 )
)Ja, ädelgasstruktur är det mest stabila tillståndet, men i många fall kan det inte bildas eftersom det för en oladdad molekyl fattas elektroner för att fylla det högsta icke tomma skalet. Även om detta inte är fullt har ofta det bundna systemet lägre energi än det obundna där atomerna är helt separerade. Molekyler bildas eftersom naturen strävar mot det lägsta möjliga energitillståndet.
Bindningsenergin för en liten molekyl är några eV, se
Se även fråga [15130].
/Peter E 2018-03-03
Länkar till externa sidor kan inte garanteras bibehålla informationen som fanns vid tillfället när frågan besvarades.
Denna sida från NRCF är licensierad under Creative Commons: Erkännande-Ickekommersiell-Inga bearbetningar