Vill du ha ett snabbt svar - sök i databasen
Nyckelord: spektrum
7 träffar
Hur uppkommer ett absorptionsspektrum?
Beskriv olika typer av spektrum såsom band-, linje-, absorbtions-, emissions- och röntgenspektrum.
1997-01-20
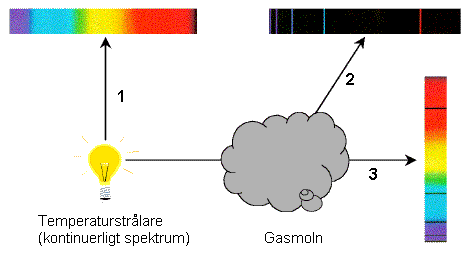
Ljuset som kommer från atomer, molekyler eller atomkärnor är "budbärare" som för med sig information om dessa mycket små kroppar som vi inte kan observera direkt. Ljus utsänds från dessa mikroskopiska kroppar när de "gör sig av" med energi.
Ett

Tydliga
Det enda sättet för en atom att ha extra energi är att elektronerna får högre energi.
I
Man kan fråga sig varför man får mörka linjer i riktning 3 när de våglängder som absorberas i gasmolnet sänds ut igen. Anledningen är att de sänds ut i alla riktningar (t.ex. i riktning 2), så det kommer färre fotoner av de absorberade/utsända våglängderna i riktning 3.
Röntgenspektra har mycket kortare våglängd än synligt ljus. Dessa spektra består av två komponeneter: dels kontinuerligt, dels ett karakteristiskt spektrum.
Studera: Studera olika spektra från gasurladdningslampor
med hjälp av spektroskop. För att se absorptionsspektrum kan Du på motsvarande sätt studera solljuset.
Jag har följande frågor att ställa.
1
Var kan man på internet hitta uppgifter om grundämnens linjespektrum i exakta siffror.
2
Är man verkligen säker på att väteatomens energinivåer ligger på Wn=13,6: n2 eV.
Eller finns det utrymme för andra teorier?
3
Har man bestämt väteatomens radie matematiskt eller experimentellt? Var kan man läsa
om dessa bestämningar?
4
Man förklarar ju linjespektrum med att fotoner hoppar mellan olika energinivåer.
Men om energin är konstant , vad finns det då att hoppa emellan?
5
Uppträder antal linjer i ett linjespektrum i förhållande till temperaturen?
Isåfall vid vilken temperatur uppträder resp linje eller våglängd?
6
Uppvisar atomer i rumstemperatur någon form av strålning?
/Anders K, Sollefteå 1998-05-04
1. Det bästa stället att hitta information om grundämnenas linjespektrum är
NIST (National Institutet of Standard and Technology) databas i USA: ATOMIC SPECTRA DATABASES
2. Verkligheten är mycket mera komplicerad. Det du beskriver med din formel
är grovstrukturen hos väte - de verkliga energierna beror också på elektronens
spinn och rörelsemängdsmoment. Grundtillståndet i väte är bestämt till nästan
godtycklig noggrannhet, teoretiskt, och experimentellt åtminstone till
åtta siffrors noggrannhet.
3. Radien på en atom är egentligen inte väldefinierad, utan beror på hur man
mäter den. Vid kollisionsförsök kan man se på träffytan en storhet som motsvarar
radien. Om man definierar storleken hos väteatomen, som att den motsvarar
den mest sannolika radien hos elektronens bana, så är den teoretiskt mycket
väl bestämd - till godtycklig noggrannhet!
4. Energinivåerna hos väteatomen är inte stabila (utom det lägsta - grundtillståndet),
utan övergångar sker spontant mellan dem. Det konstanta
hos energinivåerna är deras värden. Jämför med att läget på Lund och Sollefteå
är konstant, men man kan fortfarande förflytta sig emellan dem.
5. Olika tillstånd hos atomen, även väte, lever olika länge. En väteatom i
vätgas utsätts för kollisioner med andra atomer hela tiden. En spektrallinje
från en viss nivå kan bara observeras om fotonen utsänds tillräckligt snabbt,
innan väteatomen kolliderar med en annan väteatom. Antalet kollisioner beror
på temperaturen och därför beror linjernas uppkomst på den. De beror också på
densiteten hos gasen. Faktum är att relativa intensiteter hos linjer är ett
sätt att mäta densitet och temperatur i Universum - vi kan ju inte åka till
en avlägsen nebulosa och mäta. Spektrums utseende skvallrar om förhållandena
inuti nebulosan.
6. Ja, de kan stråla i mycket långvågigt "ljus". Väte sänder ut 21 cm strålning
genom att byta riktning på sitt kärnspinn - det händer till och med i den kalla
världsrymden!
/Tomas Brage 1997-03-20
Varför är solen gul när den är mycket varmare än en gaslåga som är blå?
Varför är solen gul när den är mycket varmare än en gaslåga som är blå? Blått är ju varmare än gult? Har det med att göra hur långt elektronerna hoppar?
/Catharina R, Sollentuna musikklasser, Sollentuna 2003-11-13
Bra fråga Catharina!
Solens "yta" (fotosfären) sänder ut temperaturstrålning, dvs elektromagnetisk strålning som utsänds från varje kropp med temperatur över absoluta nollpunkten. Maximum för denna fördelning ligger i gult för solytans temperatur, c:a 6000 grader. Temperaturstrålningen för en s.k. absolut svart kropp (en kropp som absorberar all strålning som kommer in) beror bara på temperaturen, inte sammansättningen. Spektrum för temperaturstrålningen visas nedan för några temperaturer; figuren kommer från Radiation Laws
Genom att mäta upp vid vilken våglängd maximum ligger, kan man bestämma temperaturen hos en kropp. Det är så man bestämt solytans temperatur till c:a 6000oC.
En gaslåga sänder ut ett
linjespektrum, dvs ett spektrum som består av spektrallinjer. Vilka linjer som utsänds beror på atomernas egenskaper. Så färgen på gaslågan beror på atomernas energinivåer.
Försök: tänd en bunsenlåga och justera den så den är blå. Kasta lite koksalt i lågan. Vad händer? Effekten beror på natriumet i NaCl.
Se vidare
 .
.
Hur vet man vilka ämnen solen består av?
Hur vet man vilka ämnen som solen består av? Vad har man använt för metoder för att ta reda på det?
Tack på förhand.
/Louise F, Gamlestadsskolan, Göteborg 2004-01-22
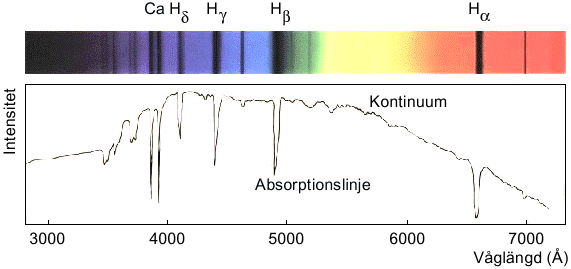
Louise! Man kan ta reda på vilka grundämnen som finns i solen och i andra stjärnor genom att analysera ljusets spektrum (se fråga 176). Alla grundämnen absorberar ljus vid specifika våglängder - detta har vi kommit fram till genom att studera ämnenas egenskaper i laboratorier här på jorden.
Om vi nu tittar efter absorptionslinjer i stjärnljusets spektrum kan vi identifiera vilka ämnen som finns i solen och i andra stjärnor, och också bestämma deras relativa mängder. Se nedanstående bild.
Det visar sig att solen består av minst 67 olika grundämnen, men två av dessa dominerar helt: väte (71.0% av massan) och helium (27.1%). Läs mer om solens sammansättning under Länk 1 och 2.
Alla stärnor innehåller mest väte och helium och halten tyngre grundänen varierar beroende på stjärnans ålder - unga stjärnor innehåller i medeltal mer tyngre ämnen än äldre.
Fundera på: vad finns det för möjliga felkällor när man använder absorptionsspektroskopi för att studera föremål som ligger väldigt långt bort från jorden?
Varför syns inte alla linjer i emissionsspektrum i ett absorptionsspektrum?
När ljus passerar genom vätgas vid rumstemperatur kan absorptionslinjer som motsvarar Lymanserien observeras? Varför syns inte de andra serierna? Vad spelar rumstemperaturen för roll? Borde det inte vara de andra serierna som syns, med tanke på att Lymanserien omfattar energisprång ner till grundtillståndet, vilket ger ultraviolett ljus som inte är synligt?
/Petra L, Södra Latin, Stockholm 2007-01-01
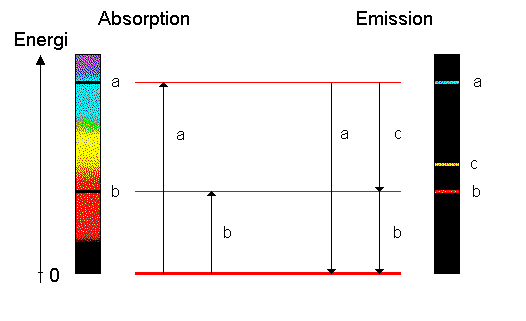
En absorptionslinje uppkommer när en foton träffar en atom och lyfter upp (exiterar) en elektron till ett högre liggande tillstånd. En emissionslinje uppkommer när elektronen hoppar tillbaka till ett lägre tillstånd. Se fråga 176 för en förklaring hur emissions- och absorptionsspekta uppkommer. Vad som inte framkommer där är att inte alla emissionslinjer förekommer i absorptionsspektrum. Om den absorberande gasen är kall, så ser man bara övergångar från grundtillståndet, a och b i nedanstående bild. Detta för att alla atomer befinner sig i grundtillståndet. I emissionsspektrum, däremot, ser man alla tre övergångarna a, b och c.
Lymanserien är den serie i vätespektrum som slutar i grundtillståndet, och eftersom alla atomer vid rumstemperatur befinner sig i grundtillståndet ser man bara lymanserien i absorption. Om temperaturen är betydligt högre kan en del av atomerna tillfälligtvis befinna sig i tillstånd ovanför grundtillståndet. Man kan då (som i solens spektrum) se även andra serier, t.ex. balmerserien, i absorption, se fråga [17723].
Varför det blir ett bandspektrum när man tittar på solen i ett spektroskop?
hej, jag undrar varför det blir ett bandspektrum när man tittar på solen i ett spektroskop. När man tittar på väte eller neon eller på ett vanligt lysrör så blir det ju ett linjespektrum. Är det så att om man bara kommer upp i ett tillräckligt högt atomnummer så smälter alla linjerna samman och bildar ett bandspektrum?
/karin e, gunnesboskolan, lund 2010-11-28
Karin! Bandspektrum uppkommer från molekyler: vibrationer och rotationer. I ett bandspektrum är ligger linjerna tätt ihop med systematiska avstånd, se fråga [176].
Det är alldeles för varmt i solens atmosfär för att det skall kunna finnas molekyler. Solspektrum innehåller emellertid väldigt många linjer, se bilden av en liten del av spektrum nedan från länk 1. Det kan kanske se ut som ett bandspektrum, men linjerna fördelar sig ganska slumpmässigt. Anledningen till att det skiljer sig från de spektra du nämner är att vi ser nästan alla existerande grundämnen i solspektrum, se länk 2.
Se även fråga [12637].

Kan en redan exciterad atom exciteras?
Hej!
Denna fråga hänger ihop med en annan redan besvarad fråga. Vid excitation av atomer; frågan var om en redan exciterad atom i sin tur kan bli exciterad? Svaret var att ja, det kan den. Om den hinner. Jag vet att en exciterad atom befinner sig i ett exciterat tillstånd under tider av storleksordningen ns. Men är det överhuvudtaget rimligt att excitera en exciterad atom, vad är sannolikheten för att det ska inträffa? Är det mätbart? Vilka parametrar kommer spela in?
/Fredrik O, Hulebäcksgymnasiet, Mölnlycke 2011-03-02
Vid speciella förhållanden kan man excitera en exciterad atom, dvs se en absorptionslinje som inte börjar i grundtillståndet, se fråga [15042]. Vad som behövs är hög temperatur och inte alltför låg densitet eller ett stort flux av strålning. En del atomer kommer då exciteras av kollisioner eller absorption av strålning. Dessa kan sedan i sin tur exciteras genom absorption.
I solspektrum finns t.ex. balmerlinjerna i absorption, se t.ex. fråga [17523] där man kan se H-gamma i absorption. H-gamma är övergången mellan tillstånd 2 och 5 i väte.
Bilden nedan (från länk 1) visar hela solspektrum.
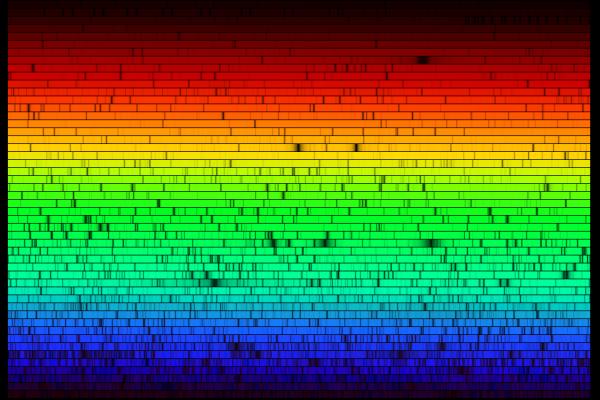
Länkar till externa sidor kan inte garanteras bibehålla informationen som fanns vid tillfället när frågan besvarades.
Denna sida från NRCF är licensierad under Creative Commons: Erkännande-Ickekommersiell-Inga bearbetningar