Vill du ha ett snabbt svar - sök i databasen: Anpassad Google-sökning 11 frågor/svar hittade Ljud-Ljus-Vågor [19863] Svar: När det gäller hur ögat uppfattar färger blir det lite mer komplicerat genom ögats konstruktion.
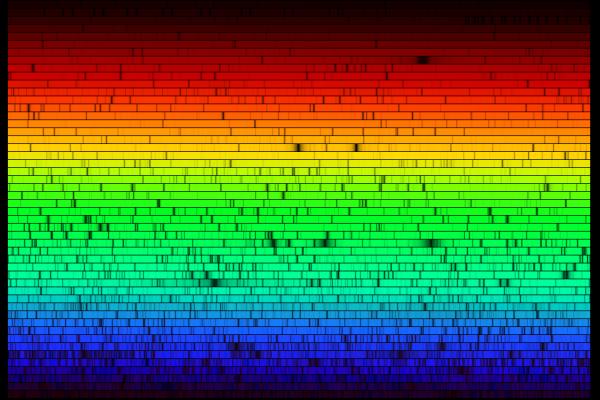
I ögat finns receptorer (tappar) som är känsliga för olika våglängder för tre grundfärger rött, grönt och blått, se fråga 13824 Se fråga 19445 Nyckelord: spektrum [11]; färg/färgseende [39]; Ljud-Ljus-Vågor [17723] Ursprunglig fråga: Svar: I solspektrum finns t.ex. balmerlinjerna i absorption, se t.ex. fråga 17523 Bilden nedan (från länk 1) visar hela solspektrum. Nyckelord: spektrum [11]; Universum-Solen-Planeterna [17523] Ursprunglig fråga: Svar: Det är alldeles för varmt i solens atmosfär för att det skall kunna finnas molekyler. Solspektrum innehåller emellertid väldigt många linjer, se bilden av en liten del av spektrum nedan från länk 1. Det kan kanske se ut som ett bandspektrum, men linjerna fördelar sig ganska slumpmässigt. Anledningen till att det skiljer sig från de spektra du nämner är att vi ser nästan alla existerande grundämnen i solspektrum, se länk 2. Se även fråga 12637 Nyckelord: spektrum [11]; 1 http://csep10.phys.utk.edu/astr162/lect/sun/spectrum.html Materiens innersta-Atomer-Kärnor [17169] På vårt fysik B-prov skulle vi rita ett energinivå-diagram för en (okänd) atom med tre nivåer. Vi fick veta vilka våglängder de tre olika observerbara fotonerna hade och att nivå ett var på -5,14 eV. Jag räknade ut energiskillnaden mellan nivå 1&3, 1&2 och 2&3. Den största skillnaden var ju såklart mellan 1&3. Sen antog jag enligt ovan att den näst största energiskillnaden var den mellan nivå 1&2, och den minsta mellan 2&3. Enligt facit så gick det också att byta plats på dessa så den minsta energiskillnaden var den mellan nivå 1&2. Går det verkligen?
Svar: När det gäller att bestämma ordningen på en kaskad av fotoner måste man ofta ta till annan information. Dels kan man - till skillnad från i kärnfysiken - beräkna energinivåer med ganska stor säkerhet och noggrannhet. Dels kan man ibland få en antydan för ordningen från intensiteten - en lägre liggande övergång har i allmänhet högre intensitet. Nyckelord: spektrum [11]; 1 http://hyperphysics.phy-astr.gsu.edu/HBASE/atomic/grotrian.html Ljud-Ljus-Vågor [15042] Ursprunglig fråga: Svar: Lymanserien är den serie i vätespektrum som slutar i grundtillståndet, och eftersom alla atomer vid rumstemperatur befinner sig i grundtillståndet ser man bara lymanserien i absorption. Om temperaturen är betydligt högre kan en del av atomerna tillfälligtvis befinna sig i tillstånd ovanför grundtillståndet. Man kan då (som i solens spektrum) se även andra serier, t.ex. balmerserien, i absorption, se fråga 17723 Se även fråga 176 Nyckelord: spektrum [11]; #ljus [63]; Ljud-Ljus-Vågor [14613] Svar: Detta används för att få vackra färger på fyrverkerier: natriumsalter ger gul färg, koppar blå, strontium röd och barium grön. Se vidare Fyrverkeri#Ingredienser_i_fyrverkerier
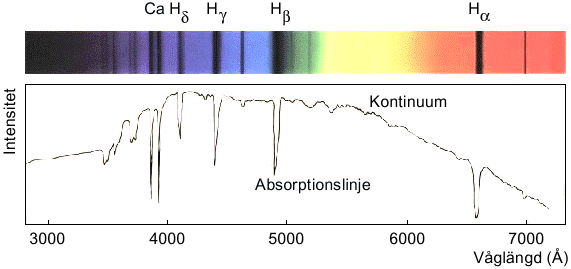
Ett temperaturstrålande gult objekt skulle ha en temperatur på c:a 6000 grader (som solens yta). Detta är uppenbarligen mycket högre temperatur än vad man har i en gnista! Se även fråga 12409 Nyckelord: spektrum [11]; temperaturstrålning [29]; #ljus [63]; Ljud-Ljus-Vågor [12816] Svar: Vi föreslår att du och dina kamrater försöker er på att repetera Newtons prismexperiment - läs mer om principerna bakom detta under länk 1. Ni behöver en "vit" ljuskälla, minst en smal spalt och två prismor. Börja med att montera alla delar så att de har samma höjd över bordet, och ta sedan ett steg i taget och pröva ut vilket avstånd till er "projektionsyta" (väggen) som blir bäst när ni har först ett prisma i ljusstrålen - ljuset böjs ju av, så det får ni ta hänsyn till! Introducera sedan ytterligare ett prisma och se hur ljuset "böjs ihop igen". Jag tror ni kommer att märka att det är både intressantare och roligare att själva "leka fram" de bästa försöksbetingelserna, än att slaviskt följa instruktioner från andra om avstånd etc. Genom att arbeta på detta sätt kommer ni mycket närmare hur "riktig forskning" går till än ni kanske anar! Nyckelord: prisma [1]; spektrum [11]; 1 http://micro.magnet.fsu.edu/primer/java/scienceopticsu/newton/ Universum-Solen-Planeterna [12637] Ursprunglig fråga: Svar: Om vi nu tittar efter absorptionslinjer i stjärnljusets spektrum kan vi identifiera vilka ämnen som finns i solen och i andra stjärnor, och också bestämma deras relativa mängder. Se nedanstående bild. Det visar sig att solen består av minst 67 olika grundämnen, men två av dessa dominerar helt: väte (71.0% av massan) och helium (27.1%). Läs mer om solens sammansättning under Länk 1 och 2. Alla stärnor innehåller mest väte och helium och halten tyngre grundänen varierar beroende på stjärnans ålder - unga stjärnor innehåller i medeltal mer tyngre ämnen än äldre. Fundera på: vad finns det för möjliga felkällor när man använder absorptionsspektroskopi för att studera föremål som ligger väldigt långt bort från jorden? Se även fråga 176 Nyckelord: spektrum [11]; 1 http://imagine.gsfc.nasa.gov/docs/ask_astro/answers/961112a.html Ljud-Ljus-Vågor [12409] Ursprunglig fråga: Svar: Solens "yta" (fotosfären) sänder ut temperaturstrålning, dvs elektromagnetisk strålning som utsänds från varje kropp med temperatur över absoluta nollpunkten. Maximum för denna fördelning ligger i gult för solytans temperatur, c:a 6000 grader. Temperaturstrålningen för en s.k. absolut svart kropp (en kropp som absorberar all strålning som kommer in) beror bara på temperaturen, inte sammansättningen. Spektrum för temperaturstrålningen visas nedan för några temperaturer; figuren kommer från Radiation Laws Genom att mäta upp vid vilken våglängd maximum ligger, kan man bestämma temperaturen hos en kropp. Det är så man bestämt solytans temperatur till c:a 6000oC. En gaslåga sänder ut ett
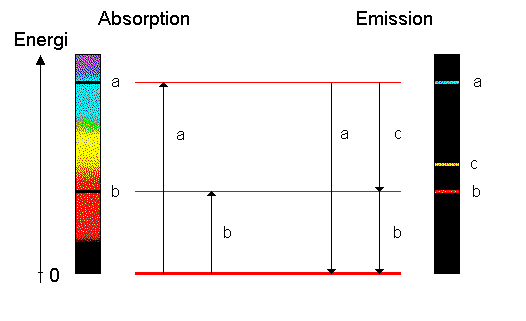
linjespektrum, dvs ett spektrum som består av spektrallinjer. Vilka linjer som utsänds beror på atomernas egenskaper. Så färgen på gaslågan beror på atomernas energinivåer. Försök: tänd en bunsenlåga och justera den så den är blå. Kasta lite koksalt i lågan. Vad händer? Effekten beror på natriumet i NaCl. Se vidare temperaturstrålning Nyckelord: spektrum [11]; Plancks strålningslag [6]; temperaturstrålning [29]; #ljus [63]; Ljud-Ljus-Vågor [176] Ursprunglig fråga: Svar: Ett spektrum får man när man delar upp ljuset efter våglängd eller frekvens. Ett kontinuerligt spektrum innehåller ljus av alla våglängder (t.ex. temperaturspektrum). Ett diskret spektrum består av ett ändligt antal ljusa linjer (t.ex. emissionsspektrum). Bandspektra är typiskt för molekyler och beror på att molekyler kan både vibrera och rotera, se bilden nedan.  Tydliga linjespektra kommer från atomer. Dessa som alltid är sfäriska kan varken rotera eller vibrera. Det enda sättet för en atom att ha extra energi är att elektronerna får högre energi. I emissionsspektra ser man ljusa linjer medan man i
absorptionsspektra skickar vitt ljus genom ett prov. Man ser då mörka linjer. Se nedanstående bild. Det kontinuerliga spektrat till vänster (riktning 1) kallas temperaturspektrum (se temperaturstrålning Man kan fråga sig varför man får mörka linjer i riktning 3 när de våglängder som absorberas i gasmolnet sänds ut igen. Anledningen är att de sänds ut i alla riktningar (t.ex. i riktning 2), så det kommer färre fotoner av de absorberade/utsända våglängderna i riktning 3. Röntgenspektra har mycket kortare våglängd än synligt ljus. Dessa spektra består av två komponeneter: dels kontinuerligt, dels ett karakteristiskt spektrum. Studera: Studera olika spektra från gasurladdningslampor med hjälp av spektroskop. För att se absorptionsspektrum kan Du på motsvarande sätt studera solljuset. 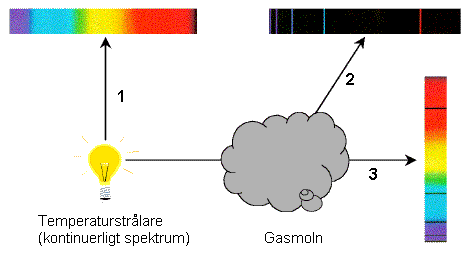 /Gunnar O/Peter E Nyckelord: spektrum [11]; temperaturstrålning [29]; #ljus [63]; * Materiens innersta-Atomer-Kärnor [2386] Fråga:Jag har följande frågor att ställa. 1 Var kan man på internet hitta uppgifter om grundämnens linjespektrum i exakta siffror. 2 Är man verkligen säker på att väteatomens energinivåer ligger på Wn=13,6: n2 eV. Eller finns det utrymme för andra teorier? 3 Har man bestämt väteatomens radie matematiskt eller experimentellt? Var kan man läsa om dessa bestämningar? 4 Man förklarar ju linjespektrum med att fotoner hoppar mellan olika energinivåer. Men om energin är konstant , vad finns det då att hoppa emellan? 5 Uppträder antal linjer i ett linjespektrum i förhållande till temperaturen? Isåfall vid vilken temperatur uppträder resp linje eller våglängd? 6 Uppvisar atomer i rumstemperatur någon form av strålning? /Anders K, Sollefteå Svar: 2. Verkligheten är mycket mera komplicerad. Det du beskriver med din formel är grovstrukturen hos väte - de verkliga energierna beror också på elektronens spinn och rörelsemängdsmoment. Grundtillståndet i väte är bestämt till nästan godtycklig noggrannhet, teoretiskt, och experimentellt åtminstone till åtta siffrors noggrannhet. 3. Radien på en atom är egentligen inte väldefinierad, utan beror på hur man mäter den. Vid kollisionsförsök kan man se på träffytan en storhet som motsvarar radien. Om man definierar storleken hos väteatomen, som att den motsvarar den mest sannolika radien hos elektronens bana, så är den teoretiskt mycket väl bestämd - till godtycklig noggrannhet! 4. Energinivåerna hos väteatomen är inte stabila (utom det lägsta - grundtillståndet), utan övergångar sker spontant mellan dem. Det konstanta hos energinivåerna är deras värden. Jämför med att läget på Lund och Sollefteå är konstant, men man kan fortfarande förflytta sig emellan dem. 5. Olika tillstånd hos atomen, även väte, lever olika länge. En väteatom i vätgas utsätts för kollisioner med andra atomer hela tiden. En spektrallinje från en viss nivå kan bara observeras om fotonen utsänds tillräckligt snabbt, innan väteatomen kolliderar med en annan väteatom. Antalet kollisioner beror på temperaturen och därför beror linjernas uppkomst på den. De beror också på densiteten hos gasen. Faktum är att relativa intensiteter hos linjer är ett sätt att mäta densitet och temperatur i Universum - vi kan ju inte åka till en avlägsen nebulosa och mäta. Spektrums utseende skvallrar om förhållandena inuti nebulosan. 6. Ja, de kan stråla i mycket långvågigt "ljus". Väte sänder ut 21 cm strålning
genom att byta riktning på sitt kärnspinn - det händer till och med i den kalla
världsrymden!
Nyckelord: spektrum [11]; *
Frågelådan innehåller 7624 frågor med svar. ** Frågelådan är stängd för nya frågor tills vidare **
|




 Sök i svenska Wikipedia:
Sök i svenska Wikipedia:
