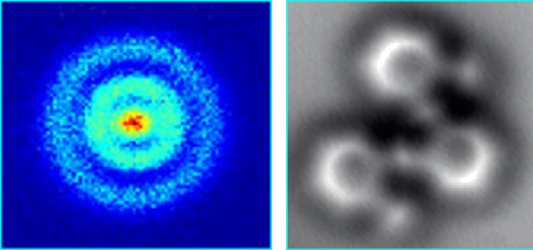
Vill du ha ett snabbt svar - sök i databasen: Anpassad Google-sökning 9 frågor/svar hittade Materiens innersta-Atomer-Kärnor [20583] Svar: Till skillnad från excitation med fotoner är kravet för oelastisk spridning av elektroner inte att energin skall vara lika med energidifferensen mellan grundtillståndet och ett exciterat tillstånd. För att få en mätbar sannolikhet måste den inkommande elektronen ha en energi som är större än energiskillnaden mellan grundtillståndet och det exciterade tillståndet. Energin som "blir över" tas om hand av den utgående elektronen och det exciterade tillståndet sönderfaller genom att sända ut en foton, se nedanstående bild. Oelastisk spridning av elektroner på fria atomer var ett mycket direkt stöd för Bohrs atommodell: Franck-Hertz försök var ett fysikexperiment som stöder Bohrs atommodell, en föregångare till kvantmekanik. De tyska fysikerna James Franck och Gustav Hertz försökte 1914 undersöka energinivåerna i en atom. Deras numera berömda experiment stödde på ett elegant sätt Niels Bohrs atommodell där elektroner rör sig runt atomkärnan i banor med specifika diskreta energier. Franck och Hertz fick 1925 Nobelpriset i fysik för detta arbete. Franck-Hertz försök bekräftade Bohrs kvantiserade atommodell genom att visa att atomer bara kan absorbera vissa specifika energimängder (kvanta). (Franck-Hertz_försök Se vidare fråga 1591 Nyckelord: Bohrs atommodell [9]; Materiens innersta-Atomer-Kärnor [19392] Ursprunglig fråga: Svar: Bilden nedan till vänster visar en bild på en väteatom framställd med en teknik som kallas kvantmikroskopi (eller fotojonisationsmikroskopi), se länk 1. Man kan se hur elektronen rör sig i ett antal moln på olika avstånd från protonen och inte i en planetbana som i Bohrs enkla atommodell. I bilden nedan till höger (länk 2) har man använt atomkraftsmikroskopi (se Atomkraftsmikroskopi En atom har en radie på ungefär 1/10 nanometer, så upplösningen är alltså betydligt bättre än detta. Nobelpriset i kemi för 2014 var för högupplöst avbildning med fotoner: Super-resolution_microscopy Nyckelord: atomradie [8]; elektronskal [12]; Bohrs atommodell [9]; 1 http://io9.com/the-first-image-ever-of-a-hydrogen-atoms-orbital-struc-509684901 Materiens innersta-Atomer-Kärnor [18154] Min fråga är följande: Har elektronerna alltid bestämda platser runt atomkärnan? När elektronen exiteras är det då samma elektron som hoppar tillbaka och sänder ut ljus eller kan det vara så att en annan elektron från de yttre skalen fyller ut platsen? Svar: Elektronerna har en viss sannoliksfördelning så man kan föreställa sig elektronerna som moln som överlappar med varandra. Alla elektroner är ekvivalenta (identiska) så övergångar kan ske med vilken elektron som helst om bara energin kan bevaras och lite andra mer avancerade villkor är uppfyllda. Så vilken elektron som bara befinner sig i ett högre tillstånd kan fylla en lägre liggande vakans. Nyckelord: Bohrs atommodell [9]; Materiens innersta-Atomer-Kärnor [16629] Ursprunglig fråga: Svar: Atomkärnor har 1 till c:a 100 positivt laddade protoner (och ett antal neutroner som vi inte behöver bekymra oss för). För att atomen skall vara oladdad måste den ha samma antal negativa elektroner som den har protoner. Detta antal kallas för atomnummer, och bestämmer vilket grundämne vi har att göra med. Enligt kvantmekanik Sammanfattning: Elektronskal är från varandra avgränsade energiintervall inom vilka elektronerna i en atom kan befinna sig. En valenselektron är en elektron i atomens yttersta skal (valensskalet). Antalet valenselektroner har stor betydelse för vilka kemiska föreningar atomen kan ingå i, det vill säga antalet bestämmer atomslagets kemiska egenskaper. Alla ädelgaser har strukturen ns2np6 i sitt yttre skal. Undantaget He som ju bara ha två elektroner 1s2. Gemensamt för alla ädelgaserna är alltså att det yttersta skalet är fullt (2 elektroner i s-tillstånd och 6 elektroner i p-tillstånd). Nyckelord: elektronskal [12]; Bohrs atommodell [9]; Materiens innersta-Atomer-Kärnor [15971] Svar: Nyckelord: Bohrs atommodell [9]; Materiens innersta-Atomer-Kärnor [14699] Svar: Se även Atomic_theory Nyckelord: vetenskaplig metod [18]; Bohrs atommodell [9]; Materiens innersta-Atomer-Kärnor [13733] Svar: Bohrs atommodell är historiskt mycket viktig, men den ger en alldeles för enkel och felaktig bild av atomen. För att få en bättre bild behöver man använda kvantmekanik. En del av denna är Heisenbergs obestämdhetsrelation som säger att läget av små partiklar som elektroner inte kan bestämmas exakt. Vi bör hellre föreställa oss elektronerna som ett negativt laddat "moln" som omger atomkärnan. Man kan alltså inte säga att elektronbanan har en viss radie, men det är fortfarande så att för högre energitillstånd är medelavstståndet från kärnan i allmänhet större. Jag tycker detta är en bättre bild än "planetmodellen" där elektronerna hoppar från en bana till en annan: Föreställ dig en elektron i ett visst tillstånd som ett negativt laddat moln runt atomkärnan. Hur laddningsfördelningen ser ut beror på tillståndet. Ett annat tillstånd har alltså en annan fördelning av den negativa laddningen. Om atomen går från det ena tillståndet till det andra, så ändras laddningsfördelningen. Denna ändring ger upphov till eller absorberar elektromagnetisk strålning (ljus). Vilka nivåer man får i en atom kan man räkna ut genom att lösa den s.k. Schrödingerekvationen (Schrödinger_equation För mer om Bohrs atommodell, se Bohr_model Nyckelord: Bohrs atommodell [9]; Heisenbergs obestämdhetsrelation [12]; kvantmekanik [30]; 1 http://kurslab.fysik.lth.se/Pi/2005/Sammanfattning/Bohr-amodell.pdf Materiens innersta-Atomer-Kärnor [1332] Svar:
Fundera: Antag att du är en skurk i vilda västern. Det kommer
en prärievagn som du tror är lastad med bomull. För att testa detta skjuter
du
hundra skott mot vagnen. 99 skott går rakt igenom vagnen medan ett studsar
tillbaks mot dig. Var vagnen lastad med bomull? Vad tror du vagnen var
lastad med?
Rutherfors experiment liknar mycket exemplet ovan. Han blev väldigt
förvånad
när nästan, men inte riktigt, alla alfapartiklarna gick rakt igenom foliet. Han tolkade detta
som att
nästan allt är tomrum men att det finns små, men mycket tunga atomkärnor
mitt inne i atomen.
Det var han som formulerade atommodellen som säger att det finns en liten
men tung kärna i mitten. Han fick Nobelpriset i kemi 1908 för tidigare arbeten om sönderfall av atomkärnor, se The Nobel Prize in Chemistry - Laureates Nyckelord: Bohrs atommodell [9]; Materiens innersta-Atomer-Kärnor [1315] Svar:
Analogi Man placerar elektronerna i atomens elektronskal ungefär
som böcker i en bokhylla. På varje plats får det bara rum en bok.
Varje elektron har fyra olika kvanttal: n, l, m, ms.
Det är svårt att ge en exakt definition av dem på "gymnasiefysiknivå". Istället
får vi ge en enkel bild enligt Bohrs atommodell.
n betecknar antalet nollställen i den radiella vågfunktionen + 1.
l anger hur utdragen banan är.
m anger hur banans plan lutar.
ms anger om spinnet är upp eller ner.
Ett röntgenspektrum uppkommer om man lyckas ta bort en elektron från ett inre skal
i atomen. När någon av de yttre elektronerna "hoppar in" till den tomma platsen
så sänds en röntgenfoton ut. Nyckelord: Bohrs atommodell [9]; pauliprincipen [10]; elektronskal [12]; Frågelådan innehåller 7624 frågor med svar. ** Frågelådan är stängd för nya frågor tills vidare **
|



 Sök i svenska Wikipedia:
Sök i svenska Wikipedia:
